泰博医疗-专业的儿科医疗连锁机构
作者: 发布时间:2016-04-13 转至微博:
|
医药网3月31日讯 继3月29日国家食药监总局公布《国家食品药品监督管理总局药物临床试验数据核查工作程序(暂行)》后,昨日(3月30日),国家食品药品审核查验中心紧接着发布《药物临床试验数据现场核查计划公告(第1号)》。
根据审核查验中心公告,国家食药监总局计划对富马酸贝达喹啉片等16个药物临床试验数据自查核查品种开展现场核查。公示期为 10 个工作日,即2016年3月30日至4月13日。
以下为本次临床试验数据现场核查品种目录:
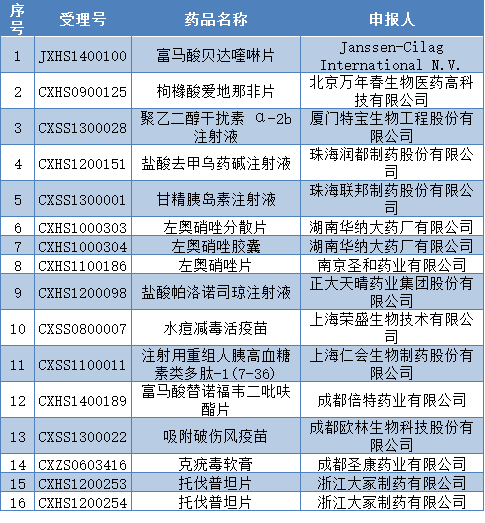 新一轮残酷的数据核查已经来临!
虽然被业内人士戏称“史上最严数据核查”的“722惨案”已告一段路,但是从官方文件来看,新一轮临床数据核查的“号角声”却已经嘹亮地吹响起来。
根据《国家食品药品监督管理总局药物临床试验数据核查工作程序(暂行)》规定,药品注册申请人在公示后10个工作日内未提出撤回申请的视为接受现场核查。网上公示期结束后,对于未提出撤回申请的品种,核查中心将通知药品注册申请人、临床试验机构及其所在地省级食品药品监管部门现场核查日期,不再接受药品注册申请人的撤回申请。
检查组应按照《药物临床试验数据现场核查要点》内容开展现场核查;核查记录应具体、准确、量化,对影响对药物安全性、有效性评价数据进行真实性、完整性判断的,应依法取证。
国家食品药品监督管理总局作出审批决定后,对现场核查发现问题而不予批准的药品注册申请相关情况予以公告。对涉嫌弄虚作假的立案调查。
从国家局发布的核查工作程序上看,被要求数据核查的品种只能在公示10天之内撤回申请,否则将接受严苛的现场核查。
据统计,在“722惨案”中,撤回和不通过的品种超过80%,其中主动撤回占了77%。主动撤回数量如此之多,与2015年第117号文件的以下要求有着密切关系:对核查中发现临床试验数据真实性存在问题的相关申请人,3年内不受理其申请。药物临床试验机构存在弄虚作假的,吊销药物临床试验机构的资格;对临床试验中存在违规行为的人员通报相关部门依法查处。将弄虚作假的申请人、临床试验机构、合同研究组织以及相关责任人员等列入黑名单。
上文第一批“被盯上”的16个品种,是会选择冒着临床试验数据真实性存在问题的风险,而硬着头皮接受核查?还是会像此前“722”一千多个品种那样,选择割肉撤回?
临床数据核查将成为常态
此前,国家药监总局局长毕井泉在座谈会上表示,将严惩故意造假,允许规范补正。中请撤回是药企的自愿行为,总局并没有对其今后的再次申报进行差别对待。对不规范、不完整的问题,允许企业重新自查,补充完善后重报。
吴浈副局长也曾公开表示,针对省局核查“不细致”“核查质量不高”等问题,国家食药监总局将继续组织核查,若发现试验数据有问题,将同时追究未能有效履职的省局核查人员的责任,并公开处理结果。加强对临床数据的核查要成为常态,凡是待审评上市的必须逐一开展临床试验数据现场核查。
今年的第一批现场核查已经来临,按国家局的要求,临床数据核查成为常态,那么第二批、第三批……第N批也将陆续到来。各大药企们,时刻准备着吧!
关键词:
|