泰博医疗-专业的儿科医疗连锁机构
作者: 发布时间:2015-07-20 转至微博:
|
医药网7月17日讯 新药研发是一个漫长而昂贵的过程,从开展最初的临床测试到新产品通过审批上市平均要花费8年的时间。各国药监部门对新药上市有严格的审批标准,新药上市前新药开发人员必须提供充足的药物安全性和有效性数据。新药上市申请失败,对防止无效或有害新药进入市场、维护患者生命安全具有重要意义。但是,许多新药上市失败,并不是因为药物不安全或无效,而是由于厂商提供给FDA的新药信息不足以支持新药上市。由于新药上市申请失败或延迟上市将会增加研发成本,因此对于企业而言,在递交新药上市申请时预先掌握新药信息不足主要体现在哪些方面,对于提高新药上市申请的成功率具有重要意义。
美国FDA的 Leonard V. Sacks等研究人员系统梳理了2000年10月1日至2012年9月30日之间向美国FDA药物评审中心提交的所有新分子实体上市申请。对失败的新药上市申请,研究人员详细研读了FDA的信函、文件等可以获得的资料,对新药上市申请失败的原因进行了深入的分析。
一、2000-2012年美国FDA新分子实体药物上市申请审批概况
2000年10月1日至2012年9月30日这12年中,共有332个新分子实体药物向美国FDA药物评审中心提交了新药上市申请。剔除23个非治疗药物(如诊断试剂)和7个在FDA决策前药厂自动撤销申请的新药外,余下的302个新分子实体药物中,151个(50%)新药通过第一轮审批顺利上市。
图1 2000-2012年美国FDA新分子实体药物上市申请结果分析
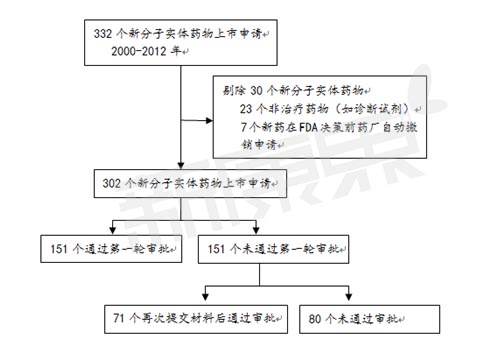 截止到2013年6月30日,第一轮申请失败的151个新分子实体药物中,87个新药(57.6%)针对同一个适应症再次提交了新药上市申请。55个新药(63.2%)在第二轮申请中获得批准,13个新药(14.9%)在第三轮申请中获得批准, 3个新药(3.4%)通过后来的多次申请终于获得批准。 在第一轮申请失败后,71个(47.0%)通过再次提交材料最终获得上市的新药平均多耗费435天(47 - 2374天)。
二、导致新药上市申请失败的主要原因
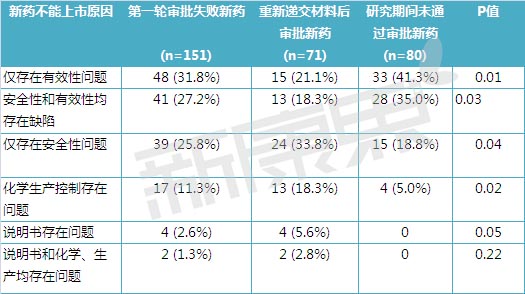
表1中详细分析了第一轮申请失败的151个新分子实体药物在安全性、有效性、说明书、化学生产控制中存在的问题。89个新药存在有效性问题,其中48个新药仅存在有效性问题,41个新药同时存在有效性和安全性问题;80个新药存在安全性问题,其中39个新药仅存在安全性问题,41个新药同时存在有效性和安全性问题;19个新药存在化学生产控制问题;6个新药存在说明书问题。从未批准新药和延迟批准新药的安全性问题发生率接近,80个从未批准新药中43个药物(53.8%)存在安全性问题,71个延迟批准新药中37 个药物(52.1%)存在安全性问题。 然而,从未批准新药有效性缺陷的发生率要显着高于延迟批准新药。80个从未批准新药中有61个药物(76.3%)存在有效性问题,71个延迟批准新药中28 个药物(39.4%)存在有效性问题。48个只存在有效性问题的新药中31.3%的新药通过后期审批上市,而39个只存在安全性问题的新药中61.5%的新药通过后期审批上市。
表1 新药上市申请第一轮失败的原因统计
关键词:
|